实验室SEC-SAXS结合其他几种技术阐明了PieE的四级结构
来自拉瓦尔大学的研究人员成功地利用蒙特利尔大学结构生物学平台上的SEC-SAXS实验室装置阐明了PieE的结构。这种酶参与抗生素杀粉蝶素的生物合成。它在NADPH、O2、PAD和C4a-hydroperosxyflavin中间体形成的帮助下,促进酶作用物的羟基化。有趣的是,这种酶具有一个控制系统,在没有酶作用物的情况下,可以防止NADPH的氧化和FAD的减少。Manenda等人最近发表的文章里,通过SEC-MALS和SAXS,结合蛋白质晶体学和活性测定,阐明了这种控制系统的分子基础。
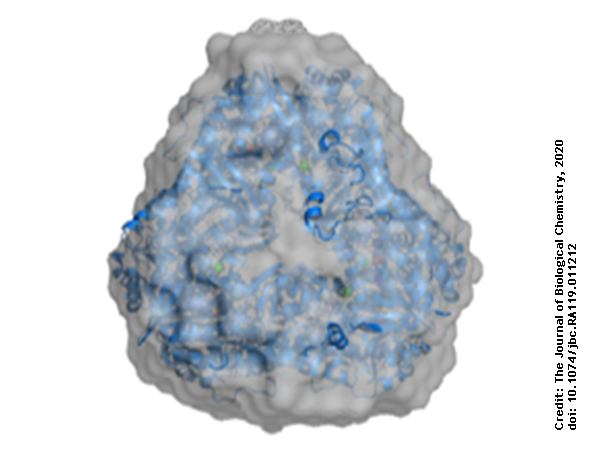
利用蛋白质晶体学,证明PieE以三种不同的晶型形成六聚体结构。然后用SEC-MALS和SAXS测定绝对分子量,确认溶液中存在低聚体。此外,SAXS还提供了更多的结构信息:用该技术确定了酶在溶液中的回转半径和最大尺寸。利用从头计算的方法进行形状重建,研究人员合成了一个虚拟原子模型拟合(图),结果表明,晶体结构在形状和体积上都基本吻合。
这两种技术的结合可以很好地测定PieE在溶液和晶体中的结构,为后续理解催化反应机理奠定了坚实的基础。结合PieE的野生型和突变体的不同状态晶体学和的活性测定,揭示了催化循环的基本步骤和构象,对整个A族黄素依赖单氧酶类非常重要,从而证明了存在于普遍IN和OUT构象之间的另一种滑移构象。