抗体-蛋白质抗原相互作用的详细生物物理描述对于指导治疗靶点的物理表征和分子工程非常重要。蛋白质可以在配体结合时发生构象变化或结构重组。X射线晶体学和核磁共振(NMR)光谱学可用于测定稳定的蛋白质之间以及蛋白质-配体复合物之间的原子结构。然而,这些技术受到过度糖基化,灵活性,稳定性和配合物的尺寸大小等限制。小角X射线散射(SAXS)可用来量化在溶液中进行配体(其他蛋白质,DNA/RNA,碳水化合物和小分子化合物)结合时的构象变化或结构重组。SAXS提供了平衡态时的信息,通过化学计量学以及在接近生理条件下的结合和分解过程。
Castellanos等人利用SAXS和尺寸排除色谱法(SEC)结合分子建模对抗链霉亲和素单克隆抗体(ASA-IgG2)和四聚物的链霉亲和素(tSA)之间的相互作用进行研究。SAXS 测试直接在大量复杂溶液(无分馏)、SEC 后收集的馏分(复杂馏分)或原位耦合 SEC-SAXS 测试中进行。
图1表明(A)ASA-IgG2-tSA复合物在低Q值下(和分子量成正比)比单一组分具有更高的强度,(B)主要复合物显示比其他两个组分具有更大的Dmax值(不管使用SEC,小部分还是大量的分离方法)。而且,从SEC-SAXS实验衍生出的化学计量表明具有两个ASA-IgG2和两个tSA分子的复合物是主馏分的主要组分。
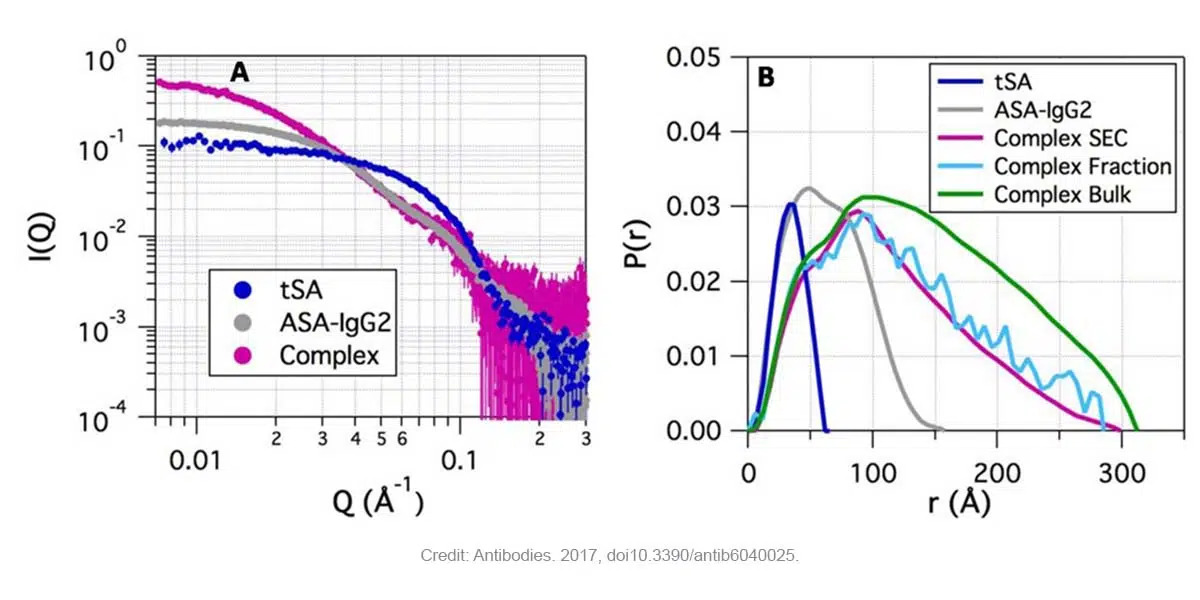
Fig. 1. ASA-IgG2, tSA和ASA-IgG2–tSA复合物在pH 6.5时的SAXS数据。(A)复合物及其组成部分的SAXS分布显示复合物在低Q时强度更高,其次是ASA-IgG2和tSA(SEC-SAXS)。(B)ASA-IgG2–tSA复合物及其组成部分的对分布函数P(r)。Credit: images extracted from Antibodies. 2017, doi10.3390/antib6040025.
Kratky图(Q2I(Q) vs Q)是对蛋白质和蛋白质-配体体系的灵活性和折叠状态的定性评估图。它提供了一种评估配体结合时体系的构象或折叠度变化的方法。折叠的蛋白质呈抛物线曲线,而未折叠的蛋白质呈双曲线。
F图2显示了tSA的抛物线曲线(钟形,球形蛋白的特征)以及ASA- A-IgG2的非抛物线曲线(由于其他柔性mAbs所固有的柔性)。同样在复合物中也观察到了非抛物线曲线。但与ASA-IgG2相比,它们在低Q值下的峰值位置不同。然而,低信噪比阻碍了在高Q值范围的比较。
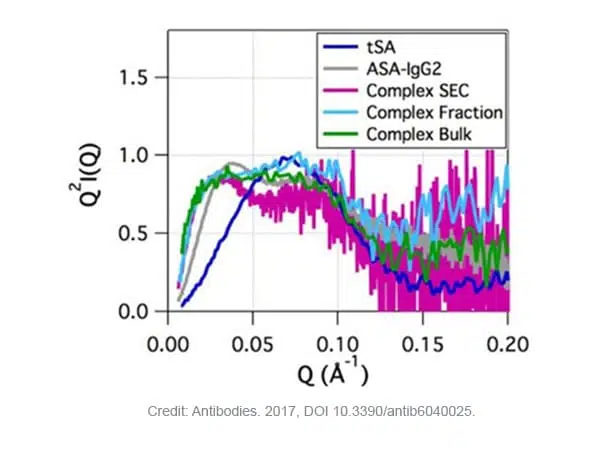
Fig. 2. ASA-IgG2–tSA复合物及其组分在pH6.5时的Kratky图。Credit: image extracted from Antibodies. 2017, DOI 10.3390/antib6040025.
使用SAXS和分子建模对溶液中ASA-IgG2-tSA复合物的化学计量和结构进行了表征。结果清晰地证明了SAXS表征溶液中蛋白质之间相互作用的能力,避免了蛋白质-蛋白质或蛋白质-配体结晶的困难条件,有时还需要筛选上千种不同的条件,以及晶体堆叠造成的假象。


