小角X射线散射(SAXS)是分析脂质体的重要工具。脂质体是一类纳米颗粒,其特征在于它们的磷脂双层壁,是少数几类纳米药物输运系统之一。SAXS是一种可用于探测纳米尺寸、形状、膜的柔韧性和活性成分与膜相互作用的有效工具。此外,SAXS提供了统计相关的结果,并且可以提供一些其他技术无法获得的关于脂质体独特的信息。
脂质体是一种主要由磷脂组成的具有脂质双层壁的球状囊泡,于60年代初被发现。脂质体尺寸从几十纳米到超过200微米不等。脂质体有两种类型:单层和多层(囊泡)。多层囊泡进一步分为多层、寡层和多囊泡脂质体(见下图)。其易于制造及生物相容性使它们成为活性药物成分 (API) 以及化妆品 [1] 和食品配方的理想载体[2]。

Doxil®、LMX-4® 和 DepoDur® 是成功上市配方的一些例子。这些注册药物的共同点是活性成分太亲脂而不能直接给药。因此,它们被封装在脂质体载体中。
利用SAXS表征脂双层和脂质双层厚度
为了保护消费者的健康并保持稳定的质量,用于这些应用的脂质体的生产受到良好生产规范 (GMP) 指南的监管。这些指南规定必须明确定义和控制制造过程,并且必须评估过程中的任何变化。[ii] 形态分析是质量控制的关键部分,小角X射线散射是非常适合的工具。
层状性,即层状双层的数量,是 FDA(食品和药物管理局)认为重要的参数之一。层状结构是脂质体容纳和保留药物物质能力的主要因素。[iii] 通过SAXS技术可以很容易得到脂质双层的数量及其确切的构造。如果与广角X射线散射(WAXS)联用,可以得到烷基链间距的信息,从而实现对凝胶,脂质或波纹相的准确测定。
例如,在来自意大利拉奎拉大学和意大利罗马大学的科学家最近发表的一篇文章中,SAXS 与其他表征方法一起用于研究喹啉在由不同脂质组成的脂质体中的负载量 [3]。喹啉是一种众所周知的通用化合物,但溶解度低限制了其对药理学应用的影响,这可以通过将其包含在脂质体中来克服。下图显示了具有不同喹啉配方的喹啉负载多层囊泡和由不同磷脂(DOPC、DPPC)制成的脂质体的 SAXS 和 WAXS 测试结果。清晰的周期性散射峰证实了具有所需层状度的囊泡的存在。载有喹啉7的DPPC脂质体是一个例外。在这里,宽的散射峰表明存在堆叠双层数量少得多的脂质体。
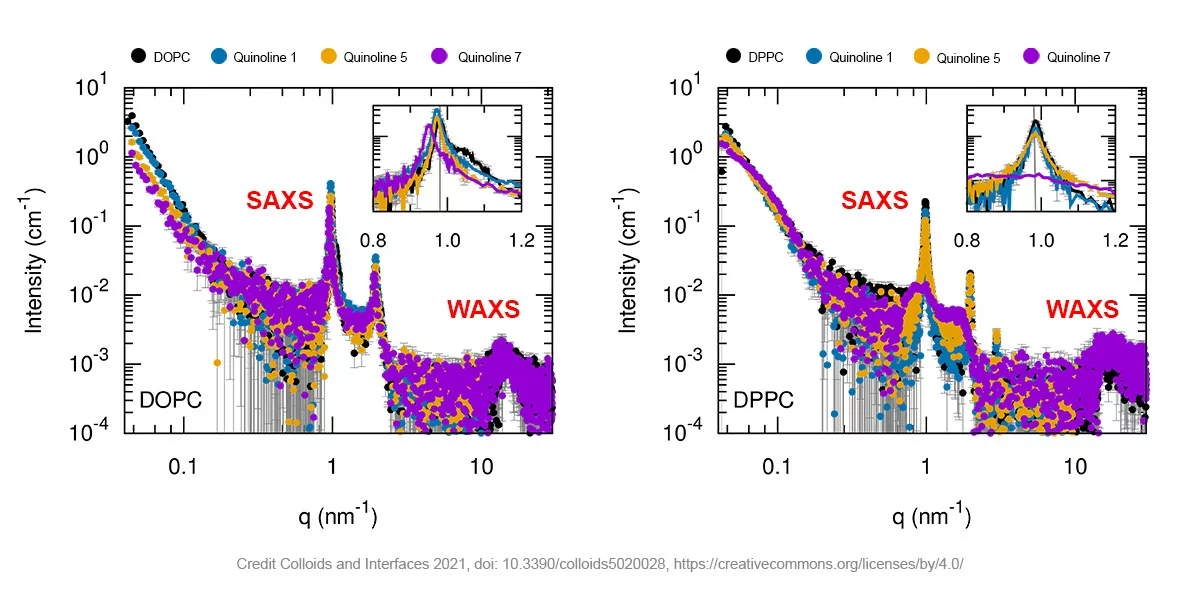
Figure 1 – 空脂质体和加入喹啉的多层囊泡磷脂的SAXS曲线(黑色曲线为空脂质体,橙色、蓝色和紫色曲线为不同喹啉配方)。图中插入的是一个放大的散射峰。该数据采集于法国Xencos公司的Xeuss 2.0 Q-Xoom(即Xeuss 3.0), 配备的是Genix3D 铜靶光源。
此外,SAXS 是表征双层厚度的首选技术,因为它具有纳米分辨率,并且因为它提供了来自 ~ 1 立方毫米样本体积的统计相关信息。它还提供了对膜柔韧性和活性成分掺入的深入了解。[1,2] 与许多其他技术相比,例如冷冻电子显微镜 (CryoEM),样品可以在接近自然状态下进行测量,准确地代表自然状态。[4] 重要的是,SAXS 允许研究上述参数作为温度和其他环境参数的函数。[1,2,4-7]
在某些情况下,SAXS 具有额外的优势,例如,它是目前测量脂质体 PEG 冠的尺寸和结构的唯一直接方法,因为对于其他技术(如冷冻 TEM)这缺乏足够的对比度。[8-9]
利用SAXS表征脂质体大小
除了双层形态研究外,SAXS 还可用于表征从几纳米到几百纳米范围内的脂质体尺寸,具体取决于脂质体和仪器的类型。在卡尔斯鲁厄理工学院 (KIT) [10] 最近的一份出版物中,SAXS 被用于研究使用脂质体作为稳定碳氟化合物乳液的一种手段。在这项基础研究中,研究了具有不同头部大小、链长和不同浓度的磷脂。首先,SAXS 明确地证实了脂质体的形成,而其他测量技术对于新制备的样品这一点尚不清楚。其次,SAXS对生产过程中引入的样品中的气泡不敏感。因此,与通过光子相关光谱 (PCS) 测量的强度加权平均流体动力学尺寸相比,SAXS 可以提供更可靠的脂质体尺寸测量方法。在这种特殊情况下,PCS 测量进一步受到两相折射率的微小差异的阻碍,这对于SAXS来说不是问题,因为其对比度依赖于电子密度而不是折射率的差异。
如下图所示,对具有不同磷脂(左)和不同浓度(右)的脂质体的散射图谱积分得到一维曲线,进行建模并进行了拟合。结果表明脂质体的大小随着磷脂尾部长度的增加而增加,从 DMPC 的 48 nm 到 DSPC 的 59 nm 和 DPPC 的 61 nm。将 DPPC 的浓度从 25 到 300 mM 变化会导致脂质体的形成从 61 nm 到超过仪器检测极限的尺寸。此外,散射强度的增加意味着存在的磷脂越多,可形成的脂质体越多。
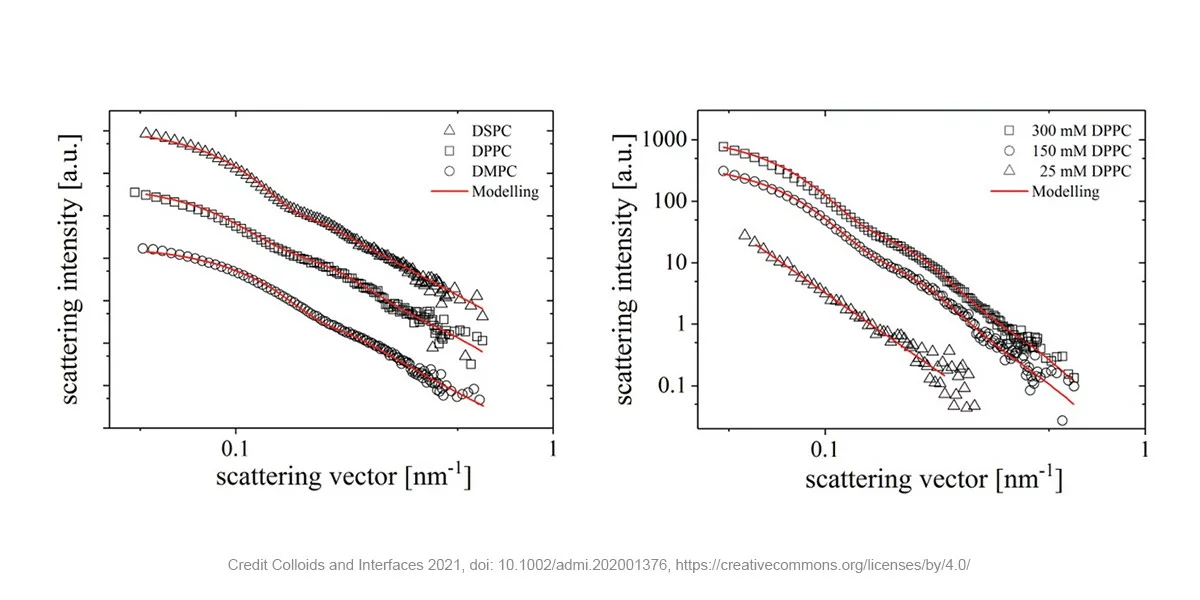
Figure 2 –用不同链长磷脂组成的不同脂质体的SAXS实验(左)或用不同浓度的DPPC制备的悬液的SAXS实验(左). SAXS数据采集自法国Xenocs公司的Xeuss 2.0,样品置于凝胶样品台中,设置样品到检测器的距离为1750毫米,单个样品测试时间为1800 s。
这些结果为开发可用于医药领域的氟碳-水乳液迈出了重要的第一步。近年来,氟碳化合物作为疏水性药物和气态氧的载体备受关注。此外,氟碳化合物还可作为磁共振成像(MRI)的造影剂。然而,目前的生产工艺远未达到最优水平,造成了大量活性成分的浪费——这一问题或许可以通过脂质体的应用得到解决。
Xenocs药物载体的研发和生产解决方案
脂质体和其他纳米粒子是药物有效载荷输送的重要载体,为解决各种药物需求提供了无限的可能性。法国Xenocs为脂质体和其他纳米粒子的有效开发提供解决方案。我们的产品通过提供更稳定可靠的结果,大大缩减了研发周期。此外,它们非常适合于生产监测和质量控制,确保高品质、安全的产品能更快地进入市场。创新的设计,核心的科技和独有的功能,使我们的产品成为市场上独特的解决方案。
References and Further Reading
-
Sreij, R.; Dargel, C.; Moleiro, L. H.; Monroy, F.; Hellweg, T. Aescin Incorporation and Nanodomain Formation in DMPC Model Membranes. Langmuir 2017, 33 (43), 12351–12361. https://doi.org/10.1021/acs.langmuir.7b02933.
-
Chaves, M. A.; Oseliero Filho, P. L.; Jange, C. G.; Sinigaglia-Coimbra, R.; Oliveira, C. L. P.; Pinho, S. C. Structural Characterization of Multilamellar Liposomes Coencapsulating Curcumin and Vitamin D3. Colloids and Surfaces A: Physicochemical and Engineering Aspects 2018, 549, 112–121. https://doi.org/10.1016/j.colsurfa.2018.04.018.
-
Battista, S.; Marsicano, V.; Arcadi, A.; Galantini, L.; Aschi, M.; Allegritti, E.; Del Giudice, A.; Giansanti, L. UV Properties and Loading into Liposomes of Quinoline Derivatives. Colloids and Interfaces 2021, 5 (2), 28. https://doi.org/10.3390/colloids5020028.
-
Borro, B. C.; Toussaint, M. S.; Bucciarelli, S.; Malmsten, M. Effects of Charge Contrast and Composition on Microgel Formation and Interactions with Bacteria-Mimicking Liposomes. Biochimica et Biophysica Acta (BBA) – General Subjects 2021, 1865 (4), 129485. https://doi.org/10.1016/j.bbagen.2019.129485.
-
Lim, S. W. Z.; Wong, Y. S.; Czarny, B.; Venkatraman, S. Microfluidic-Directed Self-Assembly of Liposomes: Role of Interdigitation. Journal of Colloid and Interface Science 2020, 578, 47–57. https://doi.org/10.1016/j.jcis.2020.05.114.
-
Wood, I.; Albano, J. M. R.; Filho, P. L. O.; Couto, V. M.; de Farias, M. A.; Portugal, R. V.; de Paula, E.; Oliveira, C. L. P.; Pickholz, M. A Sumatriptan Coarse-Grained Model to Explore Different Environments: Interplay with Experimental Techniques. Eur Biophys J 2018, 47 (5), 561–571. https://doi.org/10.1007/s00249-018-1278-2.
-
BioXolver application note ANBX06 Probing the effect of oxidation on model lipid bilayers.
-
Schilt, Y.; Berman, T.; Wei, X.; Barenholz, Y.; Raviv, U. Using Solution X-Ray Scattering to Determine the High-Resolution Structure and Morphology of PEGylated Liposomal Doxorubicin Nanodrugs. Biochim Biophys Acta 2016, 1860 (1 Pt A), 108–119. https://doi.org/10.1016/j.bbagen.2015.09.012.
-
Nordström, R.; Zhu, L.; Härmark, J.; Levi-Kalisman, Y.; Koren, E.; Barenholz, Y.; Levinton, G.; Shamrakov, D. Quantitative Cryo-TEM Reveals New Structural Details of Doxil-Like PEGylated Liposomal Doxorubicin Formulation. Pharmaceutics 2021, 13 (1), 123. https://doi.org/10.3390/pharmaceutics13010123.
-
Ullmann, K.; Meier, M.; Benner, C.; Leneweit, G.; Nirschl, H. Water-in-Fluorocarbon Nanoemulsions Stabilized by Phospholipids and Characterized for Pharmaceutical Applications. Advanced Materials Interfaces 2021, 8 (1), 2001376. https://doi.org/10.1002/admi.202001376.


