纤维素是植物纤维的主要成分,是地球上含量最丰富的有机化合物[1]。由于它具有优异的机械性能、丰富的自然资源、生物降解性、低成本和可再生性,纤维素被认为是传统石油基聚合物的一种有前景的环保替代品,可用于气凝胶、水凝胶、高韧性人造纤维或透明薄膜等领域[2]。
制造纤维素基产品的挑战之一是纤维素的高熔点,所以它不可能融化而不分解。因此,塑造纤维素材料一般需要纤维素聚合物的溶解和再生。例如纤维素再生纤维是离子溶液干喷湿纺而成的。
因此,了解生产过程中纳米结构变化是至关重要的。小角/广角X射线散射是一种理想的表征方法,在此实验中可以揭示微观结构和晶体排序的变化。此外,大部分纤维素基产品的机械性能主要取决于纤维素表面和其他材料之间的纳米和微观尺度的界面结构,特别是湿态接触点的形成,以及后期干燥过程的加固[4]。掠入射小角X射线散射(GISAXS)是表征薄膜表面,表面下层或薄膜内部纳米结构的通用工具。
在本文中,您将了解SAXS和WAXS测量是如何应用的:
- - 揭示在不同水/乙醇混合物和含有不同纤维素浓度的球形纤维素膨胀的干燥过程中发生的结构变化,
- - 测定在不同拉伸比下纤维素再生纤维结晶度的变化。
利用SAXS研究干燥过程中球形纤维素的纳米结构变化
最近,来自Jülich中子散射生物物质中心和瑞典皇家理工学院的科研人员深入研究由可再生球形纤维素组成的模型系统的纳米结构的变化。目的是研究纤维素浓度、非溶剂类型和浓度的影响[2,3]。通过将纤维素/氯化锂(LiCl)/ N,N-二甲基乙酰胺(DMAc)沉淀到非溶剂(乙醇或水)中制备出球形纤维素。随后,对水和乙醇的膨胀小球进行时间分辨SAXS测量,追踪在干燥过程中发生的纳米结构变化。根据SAXS曲线,可以将水膨胀小球分成三种干燥状态,相比较而言,乙醇膨胀小球只有两个状态。
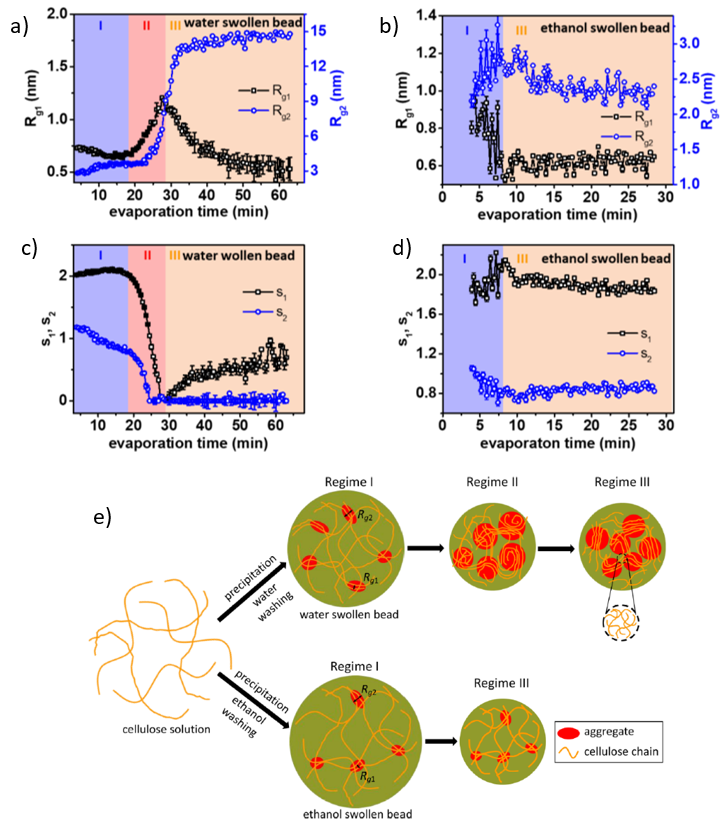
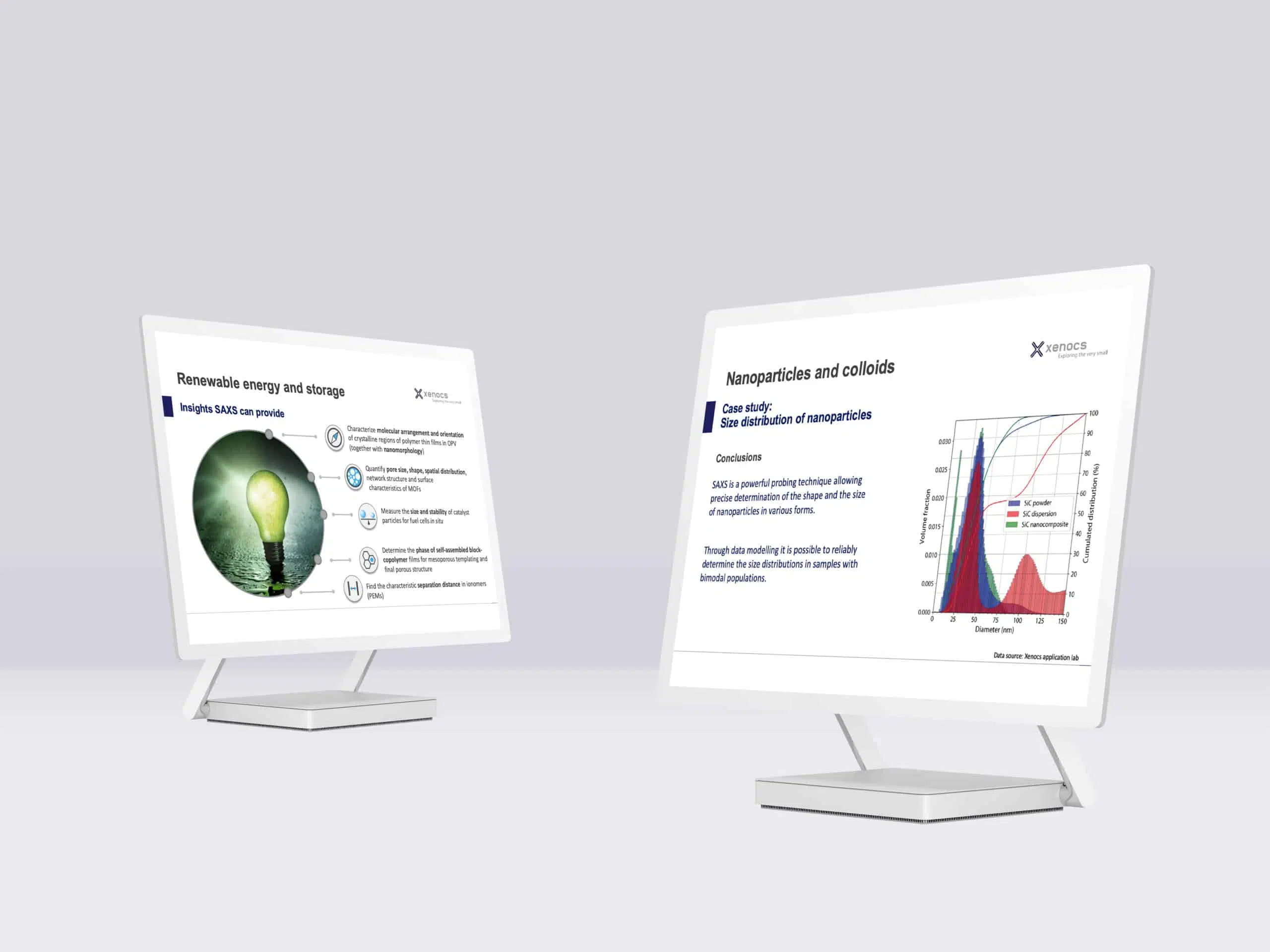
Fig. 1 (a)-(d)两种特征长度尺度的变化(Rg1和Rg2)和随着干燥时间和非溶剂变化二维参数的变化(S1和S2)。(e)非溶剂蒸发过程中结构变化的图解。Credit: ACS Nano, 2020, DOI: 10.1021/acsnano.0c00171.
为了定量评估干燥过程中结构的变化,用Guinier-Porod模型对数据进行了拟合。监控随着干燥时间的变化拟合参数的演变,可以更好理解每个状态下的结构变化。根据纤维素结构和数量级的基础知识,Rg1和Rg2这两种特征长度尺度取决于纤维素单体和细长的聚集结构的尺寸大小(见图1(e))。通过二维参数S1和S2表征相应的散射体的形状:
- 球对称 s1 = s2 = 0,
- 柱状体 s1 = 1, s2 = 0,
- (a)-(d)). 宽度长度相同的片晶S1=2,S2=0。因此,通过分析每个状态下所有参数的值,就有可能描述出在非溶剂蒸发过程中的结构变化。 (如图(a)-(d)所示).
水膨胀小球的变化图(图1 a 和c)
阶段Ⅰ(蒸发时间<18分钟)
在干燥之前,纤维素单体呈现出1nm的层状堆叠结构(对应Rg1),组合成较大的细长结构,最短的尺寸约为3nm(对应Rg2)。
阶段Ⅱ(蒸发时间18-28分钟)
S1 和S2迅速下降到0表明了球对称结构的形成。这些较大的结构是由已经存在的细长团聚体合并所形成,由Rg1和Rg1的增长表明。
阶段Ⅲ(蒸发时间>28分钟)
特征尺寸较小的形成大约0.5nm的杆状结构,而较大的则保持球形对称。
乙醇膨胀小球的变化图(图1b和d)
阶段Ⅰ和Ⅲ
在膨胀状态下(阶段Ⅰ)观察到与水膨胀小球相似的结构。它由堆叠式单体和较大的细长结构组成。此外,在整个蒸发过程中没有观察到显著的结构变化。
利用WAXS研究干燥过程中球形纤维素晶体排序的变化
WAXS实验已被用在研究蒸发过程中是否有晶体的形成。对于水膨胀小球,在图2 (a) 和(b)所示的光谱中可以观察到三个峰:来自水的散射峰(q = 20 nm-1)和分布在纤维素Ⅱ结构的晶面的两个峰(110) (q = 8.8 nm-1) 和(110) (q = 14.6 nm-1)。随着蒸发时间的变化,水的散射峰明显降低,而纤维素峰只出现在阶段Ⅱ的开始阶段(18分钟),随之强度增加。峰在(110)方向移动说明在阶段Ⅱ的开始纤维素水合物结构形成,随之连续过渡到纤维素Ⅱ结构。
另一方面,乙醇膨胀小球在干燥过程中没有形成晶体结构。在此例子中,只有乙醇(q = 15.5 nm-1)和纤维素(q = 14.6 nm-1)峰的强度变化在整个非溶剂蒸发过程中可以观察得到。
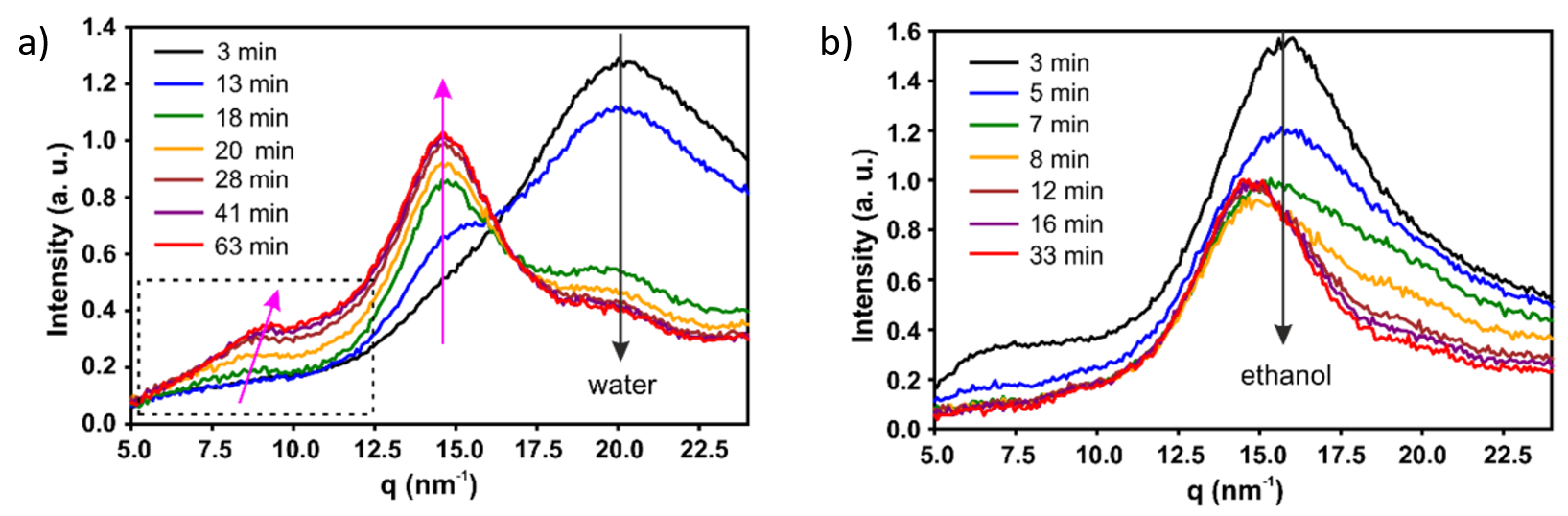
Fig. 2 (a), (b)WAXS曲线分别记录了纤维素浓度为1.5 wt%的水和乙醇膨胀小球在干燥过程中不同时间的变化。Credit: ACS Nano, 2020, DOI: 10.1021/acsnano.0c00171.
此外,通过对含有不同浓度纤维素的水或乙醇混合物膨胀的不同纤维素样品进行SAXS/WAXS实验,可以构成如图3所示的相图,从而可以直接预测可再生纤维素的干燥行为。
Fig. 3 相图显示在球形纤维素干燥过程中随着非溶剂混合物变化结构的演变。红色点对应的是纤维素结构没有变化的两阶段干燥过程,绿色点代表结构急剧变化的三阶段干燥过程。Credit: ACS Nano, 2022, DOI: 10.1021/acsnano.1c09338.
纤维素再生纤维的结晶度
来自巴里大学、阿尔托大学、结晶学研究所和隆德大学的科研人员对纤维素再生纤维的结晶度进行了研究[5]。一般来说,聚合物结晶只与分子链通过冷却、机械拉伸或溶剂蒸发的部分排列有关。结果是非晶态和晶态的比例可以通过加工参数调整,例如拉伸比。
通过广角X射线散射测试,评估了拉伸比对纤维素再生纤维结晶度的影响。为了准确地测定纤维结晶度(ϕc),即晶区的体积分数,WAXS曲线已经分峰成单独的非晶态和晶态,如图4插图所示。随着拉伸比的增加,ϕc急剧增加到DR=5,在更高的拉伸比ϕc在0.6 ± 0.05时达到稳定。这种行为与不同DR制成的纤维素的机械性能演变有关。拉伸强度在较低拉伸比(DR<5)时增加约2倍,随后在较高拉伸比下持续缓慢地增加[6]。
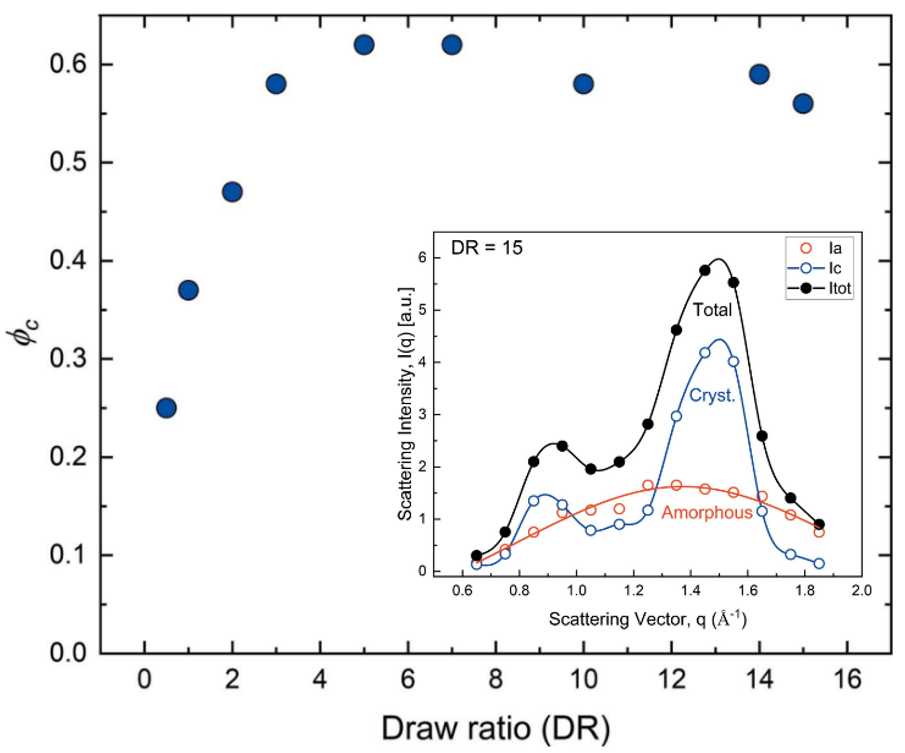
Fig. 4 不同拉伸比(DR)下纤维结晶度。(插图)在DR15样品的晶态和非晶态的WAXS图谱。Credit: IUCrJ, 2022, DOI: 10.1107/S205225252200570X.
结论
通过SAXS/WAXS测量详细研究了不同纤维素浓度的球形纤维素在充满不同非溶剂水或乙醇混合物中的干燥动力学变化。结果证明,在干燥过程中不同的结构变化取决于纤维素浓度以及所用的非溶剂。此外,WAXS是一种理想的工具,用来测定用不同拉伸比生产的纤维素再生纤维的结晶度。这项研究工作对于再生纤维干燥过程中的机制和工艺参数的影响提供了非常有价值的信息,所提供的这些观点在大量纤维素基产品的制造过程中具有非常重要的作用。
References and further reading
The research was originally published in the following articles:
[2] Li, Hailong, Margarita Kruteva, Martin Dulle, Zhen Wang, Katarzyna Mystek, Wenhai Ji, Torbjörn Pettersson, and Lars Wågberg. “Understanding the Drying Behavior of Regenerated Cellulose Gel Beads: The Effects of Concentration and Nonsolvents.” ACS nano 16, no. 2 (2022): 2608-2620.
[3] Li, Hailong, Margarita Kruteva, Katarzyna Mystek, Martin Dulle, Wenhai Ji, Torbjörn Pettersson, and Lars Wågberg. “Macro-and microstructural evolution during drying of regenerated cellulose beads.” ACS nano 14, no. 6 (2020): 6774-6784.
[5] Gentile, Luigi, Herbert Sixta, C. Giannini, and U. Olsson. “A novel X-ray diffraction approach to assess the crystallinity of regenerated cellulose fibers.” IUCrJ 9, no. 4 (2022).
[1] Wang, Sha, Tian Li, Chaoji Chen, Weiqing Kong, Shuze Zhu, Jiaqi Dai, Alfredo J. Diaz et al. “Transparent, anisotropic biofilm with aligned bacterial cellulose nanofibers.” Advanced Functional Materials 28, no. 24 (2018): 1707491.
[2] Li, Hailong, Margarita Kruteva, Martin Dulle, Zhen Wang, Katarzyna Mystek, Wenhai Ji, Torbjörn Pettersson, and Lars Wågberg. “Understanding the Drying Behavior of Regenerated Cellulose Gel Beads: The Effects of Concentration and Nonsolvents.” ACS nano 16, no. 2 (2022): 2608-2620.
[3] Li, Hailong, Margarita Kruteva, Katarzyna Mystek, Martin Dulle, Wenhai Ji, Torbjörn Pettersson, and Lars Wågberg. “Macro-and microstructural evolution during drying of regenerated cellulose beads.” ACS nano 14, no. 6 (2020): 6774-6784.
[4] Li, Hailong, Stephan V. Roth, Guillaume Freychet, Mikhail Zhernenkov, Nadia Asta, Lars Wågberg, and Torbjorn Pettersson. “Structure development of the interphase between drying cellulose materials revealed by in situ grazing-incidence small-angle X-ray scattering.” Biomacromolecules 22, no. 10 (2021): 4274-4283.
[5] Gentile, Luigi, Herbert Sixta, C. Giannini, and U. Olsson. “A novel X-ray diffraction approach to assess the crystallinity of regenerated cellulose fibers.” IUCrJ 9, no. 4 (2022).
[6] Asaadi, Shirin, Michael Hummel, Patrik Ahvenainen, Marta Gubitosi, Ulf Olsson, and Herbert Sixta. “Structural analysis of Ioncell-F fibres from birch wood.” Carbohydrate polymers 181 (2018): 893-901.